ACLR a Neuroplastyczność cz. 1

Zerwanie przedniego więzadła krzyżowego stawu kolanowego (ACLR) jest obecnie jedną z najpowszechniejszych kontuzji wśród sportowców i osób aktywnych [1]. Mimo wielu lat badań, nadal niewiele wiadomo jak najlepiej chronić wspomniane więzadło przed uszkodzeniem oraz jak najefektywniej przeprowadzać rehabilitację, aby pacjent stanął jak najszybciej na nogi. Co gorsza, w przypadku młodych sportowców, ponad 23-30% z nich doznaje ponownego urazu kolana [2,3]. To może sugerować, że współczesnej rehabilitacji coś umyka i osoby nie są w wystarczający sposób przygotowane do ponownej aktywności w środowisku sportowym. Bardzo dużą uwagę przykłada się do wzmocnienia mięśnia czworogłowego i przywrócenia pełnego zakresu ruchu, jednak czy tylko na poziomie aparatu mięśniowo-więzadłowego dochodzi do uszkodzenia? Okazuje się, że nie. Naszemu układowi nerwowemu, również się obrywa i to właśnie jemu się dzisiaj przyjrzymy.
Anatomia (w dużym uproszczeniu)
Układ nerwowy składa się z ośrodkowego (mózg i rdzeń kręgowy) [4] i obwodowego układu nerwowego (włókna czuciowe i ruchowe) [5]. W przypadku układu mięśniowo-ścięgnistego, mózg, poprzez drogę czuciową (afferentną) przesyła informacje z proprioceptorów, które znajdują się w mięśniach i ścięgnach. Następnie przepuszcza sygnały przez swoje specjalne obszary i drogą ruchową (efferentną), przesyła odpowiedź zwrotną do mięśni. W momencie, gdy dojdzie do uszkodzenia na drodze czuciowej (zerwanie więzadła), nasz mózg może wysyłać błędne informacje drogą ruchową [6]. Jeśli chodzi o sam mózg, to skupimy się na regionie kory ruchowej, której poszczególne obszary odpowiedzialne są za planowanie oraz wykonywanie ruchów.
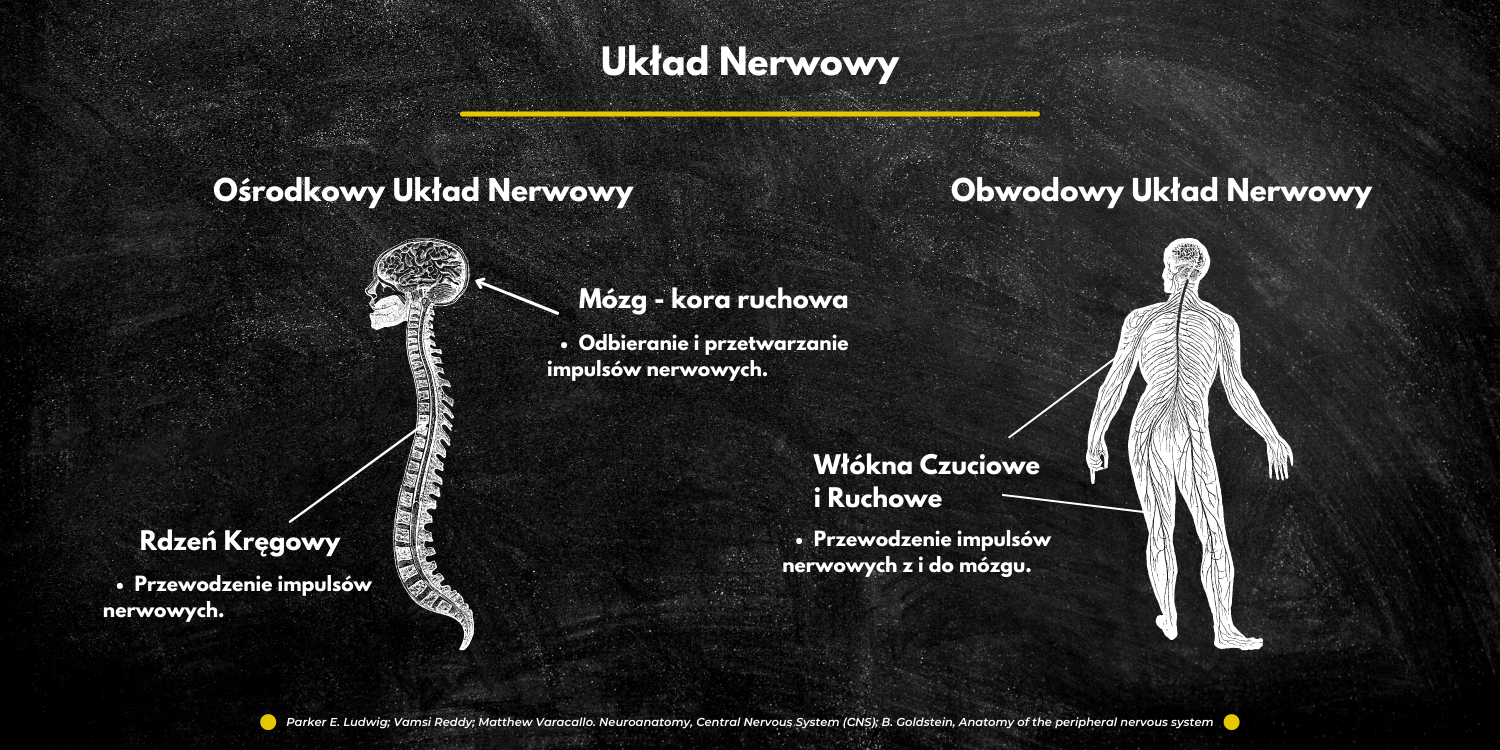
W przypadku mózgu skupimy się na regionie kory ruchowej, której poszczególne obszary odpowiedzialne są za planowanie oraz wykonywanie ruchów.
Zmiany w Ośrodkach Mózgu po Zerwaniu ACL
Do niedawna uważano, że zerwanie ACL to wyłącznie problem na poziomie tkankowym i wystarczy wykonać rekonstrukcję, trochę poćwiczyć i będziemy jak nowi. Niestety, w praktyce nie wygląda(ło) to tak kolorowo. Częstość ponownych urazów ACL sprawiła, że badacze zaczęli baczniej przyglądać sie zmianom wynikającym z uszkodzenia i swój wzrok zwrócili w kierunku mózgu, a dokładniej kory ruchowej. Pierwsze badanie, z wykorzystaniem MRI na temat neuroplastyczności po ACLR, pojawiło się stosunkowo niedawno, bo w 2009 roku [11]. Do tej pory korzystano z EEG, TMS lub EMG, lecz fMRI i MRI pozwalają na pomiar struktury i funkcji kory mózgowej i podkorowej mózgu z większą rozdzielczością przestrzenną.
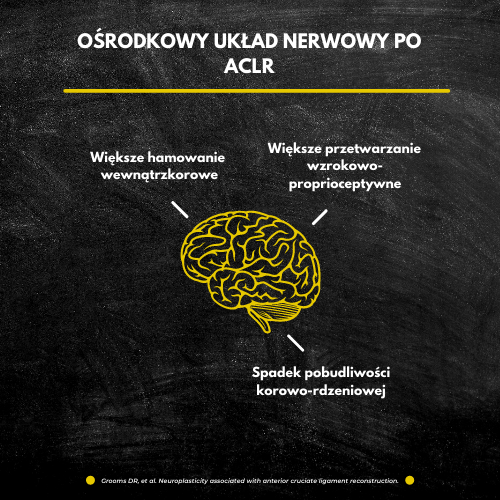
W przypadku ACLR najczęściej badaną grupą mięśniową jest czworogłowy uda. Wykorzystuje się do tego m.in. przezczaszkową stymulację elektryczną (TMS), EEG czy od niedawna MRI. W badaniu Zarzyckiego i współ. [12] przy użyciu TMS, zmierzono pobudliwość korowo-rdzeniową oraz śródkorową i okazało się, że w przypadku osób z ACLR, w porównaniu do zdrowej grupy kontrolnej, zaobserwowano wzmożoną aktywność obszarów kory ruchowej. Podobne wyniki uzyskano w kilku innych badaniach z wykorzystaniem EEG [13], MRI [14, 15] czy również TMS [16]. Po ACLR dochodzi do zwiększonego hamowania wewnątrzkorowego i obniżonej pobudliwości korowo-rdzeniowej, co skutkuje zmniejszoną dobrowolną aktywacją mięśnia czworogłowego. Co więcej, naukowcy postawili hipotezę, zgodnie z którą po urazie ACL pacjenci przestawiają się z czuciowo-ruchowej na wizualno-ruchową strategię aktywacji mózgu w celu kontroli motorycznej kolana [17, 18]. Mózgi osób po urazie wykazują większą aktywność w obszarach odpowiedzialnych za widzenie, to sugeruje większe przetwarzanie wzrokowo-proprioceptywne.
Mechanoreceptory naszych mięśni i stawów, czyli proprioceptory
Jak już wspomniałem, w naszych mięśniach i stawach znajdują się specjalne receptory o nazwie prioproceptory. Z funkcjonalnego punktu widzenia propriocepcja ACL składa się z trzech głównych elementów: (1) statycznej świadomości pozycji stawu kolanowego; (2) dynamicznego wykrywania ruchu i przyspieszenia kolana; oraz (3) łuku odruchowego z zamkniętą pętlą, który wywołuje odruchowe reakcje hamstringów i reguluje synergistyczne i antagonistyczne skurcze mięśni (7,8). Jak pokazuje badanie na 128 zwłokach z 2016 roku Cabuka i współ. w więzadłach stawu kolanowego znajdują się mechanoreceptory z grup I, III i VI - ciałka Ruffiniego, aparat ścięgnisty Golgiego oraz wolne zakończenia nerwowe (9). Poniżej charakterystyka mechanoreceptorów według Freemana i Wekesa (10):

Okazuje się, że w wyniku zerwania ACL, dochodzi do uszkodzenia/usunięcia części proprioceptorów, przez co zostaje pogorszona propriocepcja stawu. Niestety, przeszczep więzadła nie naprawia tego uszkodzenia. Niezależnie czy jest to przeszczep allo czy autograficzny, nie obserwuje się ponownego unerwienia więzadła [19]. To wpływa na pogorszenie kinestetyki stawu oraz osłabienie odpowiedzi somatosensorycznej. Odpowiednie odczucie ruchu i pozycji stawu w prawie końcowej pozycji kolana [21] ma znaczenie kliniczne w stanach, w których wymagane jest synergistycznie bierne (więzadłowe) i czynne (kurczliwe) unieruchamianie przedniej translacji lub naprężenia rotacyjnego kości piszczelowej [24, 25, 26]. Wspomniane wyżej warunki obejmują manewry skoków, obrotu i lądowania, co do których dowody naukowe wskazują, że słaba propriocepcja jest silnie związana z dysfunkcją motoryczną [27, 28]. Osłabione lądowanie [29] i mechanika skakania [30, 31] pojawiają się u pacjentów z jednostronną rekonstrukcją ACL. Co ciekawe w przypadku osób, u których nie dokonano rekonstrukcji więzadła, zaobserwowano lepszą propriocepcję stawu, niż u ich odpowiedników po przeszczepie [32]. To może wskazywać, że kikuty więzadła, które pozostały, nadal wysyłają sygnał do OUN, dzięki czemu może być korzystne wykonanie rekonstrukcji z zachowaniem pozostałości ACL.
W przypadku badań nad propriocepcją należy mieć na uwadze, że obecne publikacje ograniczają się w dużej mierze do okresu 24 miesięcy. Pomiary dokonywane są w różnych pozycjach, kątach, kierunkach ruchu i za pomocą różnych technik. Ponadto, prace skupiają się na mięśniu czworogłowym, który owszem, odgrywa kluczową rolę w stabilizacji stawu kolanowego, jednak mięśnie hamstringów również mają tutaj pewien wkład. Swoim działaniem ograniczają przednią translację kości piszczelowej [33]. Dodatkowo, badania wykazały istnienie odruchu mięśniowo-ścięgnistego między ACL a hamstringami [34,35].
Należy pamiętać, że z uwagi na mała liczbę badań, obecnie nie wiadomo czy i w jaki sposób „podstawowe” różnice w aktywności mózgu są związane ze zwiększonym ryzykiem wystąpienia w przyszłości urazu ACL. Można to zbadać, włączając pomiary aktywności mózgu do oceny różnych populacji sportowych, co pozwoliłoby potwierdzić pewien profil aktywności mózgu związany ze zwiększonym ryzykiem przyszłego uszkodzenia ACL.
Podsumowanie
Dotychczasowe badania wskazują na neuroplastyczność ACL po zerwaniu, zarówno w obszarze sensorycznym jak i motorycznym kory ruchowej. Możliwym czynnikiem mającym wpływ na taki stan rzeczy jest uszkodzenie proprioceptorów w więzadle krzyżowym. To może powodować zaburzenie w odpowiedzi sensorycznej i osłabiać stabilizację stawu. Jak się okazuje, siła to nie wszystko i warto uwzględnić w planie rehabilitacji pracę nad nauką motoryczną, w wyniku czego, spadnie zaangażowanie ośrodku wzroku w trakcie ruchu, a wzrośnie obszarów sensomotorycznych.
Referencje:
1. Sanders TL, Maradit Kremers H, Bryan AJ, et al. Incidence of anterior cruciate ligament tears and reconstruction: a 21-year population-based study. Am J Sports Med. 2016;44(6):1502–1507.
2. Lindsay V. Slater, Erin B. Wasserman and Joseph M. Hart. Trends in Recurrent Anterior Cruciate Ligament Injuries Differ From New Anterior Cruciate Ligament Injuries in College and High School Sports: 2009-2010 Through 2016-2017
3. R. B. Frobell, H. P. Roos, E. M. Roos, F. W. Roemer, J. Ranstam, and L. S. Lohmander, “Treatment for acute anterior cruciate ligament tear: five year outcome of randomised trial,” British Journal of Sports Medicine, vol. 49, no. 10, p. 700, 2015.
4. Parker E. Ludwig; Vamsi Reddy; Matthew Varacallo. Neuroanatomy, Central Nervous System (CNS)
5. B. Goldstein, Anatomy of the peripheral nervous system
6. J.Fleming, R. Ritzmann & C. Centner; Effect of an Anterior Cruciate Ligament Rupture on Knee Proprioception Within 2 Years After Conservative and Operative Treatment: A Systematic Review with Meta-Analysis
7. Adachi N, Ochi M, Uchio Y, Iwasa J, Ryoke K, Kuriwaka M. Mechanoreceptors in the anterior cruciate ligament contribute to the joint position sense. Acta Orthop Scand. 2002;73(3):330–4.
8. Johansson H. Role of knee ligaments in proprioception and regulation of muscle stiffness. J Electromyogr Kinesiol. 1991;1(3):158–79.
9. Çabuk H, Kuşku Çabuk F. Mechanoreceptors of the ligaments and tendons around the knee. Clin Anat. 2016 Sep;29(6):789-95. doi: 10.1002/ca.22743. Epub 2016 Jul 27. PMID: 27376635
10. Freeman M, Wyke B. The innervation of the knee joint. An anatomical and histological study in the cat. J Anat 1967;101:505-532 (Pt 3).
11. E. Kapreli, S. Athanasopoulos, J. Gliatis et al., “Anterior cruciate ligament deficiency causes brain plasticity: a functional MRI study,” The American Journal of Sports Medicine, vol. 37, no. 12, pp. 2419–2426, 2009.
12. Zarzycki R, Morton SM, Charalambous CC, Marmon A, Snyder-Mackler L. Corticospinal and intracortical excitability differ between athletes early after ACLR and matched controls. J Orthop Res. 2018;36(11):2941–8
13. J. Baumeister, K. Reinecke, and M. Weiss, “Changed cortical activity after anterior cruciate ligament reconstruction in a joint position paradigm: an EEG study,”
14. E. Kapreli, S. Athanasopoulos, J. Gliatis et al., “Anterior cruciate ligament deficiency causes brain plasticity: a functional MRI study,”
15. D. R. Grooms, S. J. Page, D. S. Nichols-Larsen, A. M. W. Chaudhari, S. E. White, and J. A. Onate, “Neuroplasticity associated with anterior cruciate ligament reconstruction,”
16. B. G. Pietrosimone, A. S. Lepley, H. M. Ericksen, A. Clements, D. H. Sohn, and P. A. Gribble, “Neural excitability alterations after anterior cruciate ligament reconstruction,”
17. Grooms D, Appelbaum G, Onate J. Neuroplasticity following anterior cruciate ligament injury: a framework for visual-motor training approaches in rehabilitation. J Orthop Sports Phys Ther. 2015;45(5):381–93.
18. Grooms DR, Page SJ, Nichols-Larsen DS, Chaudhari AM, White SE, Onate JA. Neuroplasticity associated with anterior cruciate ligament reconstruction. J Orthop Sports Phys Ther. 2017;47(3):180–9.
19. Young SW, Valladares RD, Loi F, Dragoo JL. Mechanoreceptor reinnervation of autografts versus allografts after anterior cruciate ligament reconstruction. Orthop J Sports Med. 2016;4(10):2325967116668782.
20. Riemann BL, Lephart SM. The sensorimotor system, part I: the physiologic basis of functional joint stability. J Athl Train. 2002;37(1):71–9.
21. J. Fleming, R.Ritzmann, C. Centner; Effect of an Anterior Cruciate Ligament Rupture on Knee Proprioception Within 2 Years After Conservative and Operative Treatment: A Systematic Review with Meta-Analysis; Sports Med . 2021 Dec 2. doi: 10.1007/s40279-021-01600-z
24. Markolf KL, Burchfield DI, Shapiro MM, Shepard ME, Finerman GAM, Slauterbeck JL. Combined knee loading states that generate high anterior cruciate ligament forces. J Orthop Res. 1995;13(6):930–5.
25. Renstrom P, Arms SW, Stanwyck TS, Johnson RJ, Pope MH. Strain within the anterior cruciate ligament during hamstring and quadriceps activity. Am J Sports Med. 1986;14(1):83–7.
26. DeMorat G, Weinhold P, Blackburn T, Chudik S, Garrett W. Aggressive quadriceps loading can induce noncontact anterior cruciate ligament injury. Am J Sports Med. 2004;32(2):477–83.
27. Barrett DS. Proprioception and function after anterior cruciate reconstruction. J Bone Jt Surg Br. 1991;73(5):833–7.
28. Nagai T, Sell TC, House AJ, Abt JP, Lephart SM. Knee proprioception and strength and landing kinematics during a single-leg stop-jump task. J Athl Train. 2013;48(1):31–8.
29. Bell DR, Smith MD, Pennuto AP, Stiffler MR, Olson ME. Jump-landing mechanics after anterior cruciate ligament reconstruction: a landing error scoring system study. J Athl Train. 2014;49(4):435–41.
30. Delahunt E, Sweeney L, Chawke M, Kelleher J, Murphy K, Patterson M, et al. Lower limb kinematic alterations during drop vertical jumps in female athletes who have undergone anterior cruciate ligament reconstruction. J Orthop Res. 2012;30(1):72–8.
31. Kuenze CM, Foot N, Saliba SA, Hart JM. Drop-landing performance and knee-extension strength after anterior cruciate ligament reconstruction. J Athl Train. 2015;50(6):596–602.
32. Dhillon MS, Bali K, Prabhakar S. Differences among mechanoreceptors in healthy and injured anterior cruciate ligaments and their clinical importance. Muscles Ligaments Tendons J. 2012;2(1):38–43.
33. B. A. MacWilliams, D. R. Wilson, J. D. Desjardins, J. Romero, and E. Y. S. Chao, “Hamstrings cocontraction reduces internal rotation, anterior translation, and anterior cruciate ligament load in weight-bearing flexion,” Journal of Orthopaedic Research, vol. 17, no. 6, pp. 817–822, 1999.
34. T. Takenaga, K. Sugimoto, H. Goto et al., “Posterior shoulder capsules are thicker and stiffer in the throwing shoulders of healthy college baseball players: a quantitative assessment using shear-wave ultrasound elastography,” The American Journal of Sports Medicine, vol. 43, no. 12, pp. 2935–2942, 2015.
35. M. Solomonow, R. Baratta, B. H. Zhou et al., “The synergistic action of the anterior cruciate ligament and thigh muscles in maintaining joint stability,” The American Journal of Sports Medicine, vol. 15, no. 3, pp. 207–213, 1987.
